新生儿溶血性贫血是一种因母婴血型不合引发免疫反应、导致胎儿或新生儿红细胞破坏的疾病,严重时可危及生命。本文将系统解析其发病机制、临床表现及防治策略,帮助公众科学认识并应对这一健康问题。
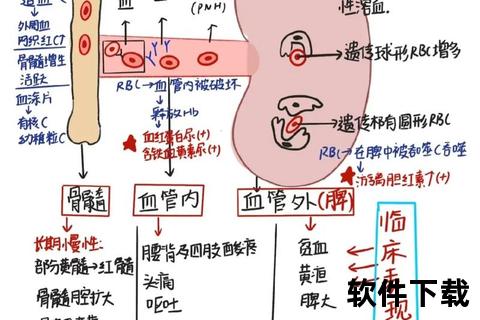
当母亲与胎儿的红细胞表面抗原不母体免疫系统会将胎儿红细胞视为“入侵者”,产生特异性抗体(IgG型)。这些抗体通过胎盘进入胎儿体内,与红细胞结合后引发溶血反应。最常见的两类血型不合为:
1. ABO血型不合(占85%以上):母亲为O型血,胎儿为A型或B型。由于O型血母亲天然存在抗A、抗B抗体,首胎即可发病,但症状通常较轻。
2. Rh血型不合(以RhD抗原为主):母亲为Rh阴性,胎儿为Rh阳性。第一胎极少发病,但再次妊娠时母体抗体浓度升高,易导致重度溶血。
其他罕见因素如红细胞酶缺陷(如G6PD缺乏症)、遗传性球形红细胞增多症等也可能引起溶血,但占比不足15%。
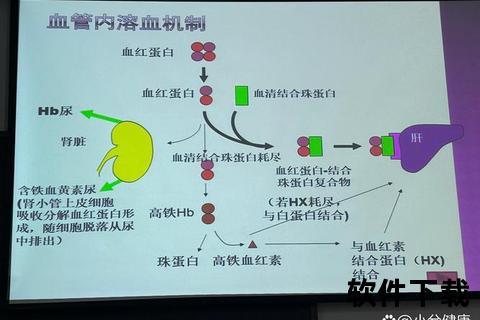
新生儿溶血性贫血的严重程度与抗体浓度、胎儿代偿能力密切相关,典型表现包括:
特殊群体差异:早产儿因肝脏代谢能力弱,更易出现高胆红素血症;Rh阴性母亲多次妊娠者,胎儿溶血风险呈指数级上升。
1. 产前监测
2. 产后确诊
• 血型鉴定(母婴血型不合)
• Coombs试验(直接法检测红细胞抗体)
• 胆红素及血红蛋白动态监测。
根据《新生儿高胆红素血症诊疗专家共识》,治疗需遵循“三步走”原则:
1. 基础治疗
2. 药物干预
3. 换血疗法
适用于胆红素超过换血阈值(如足月儿≥25mg/dL)或出现神经系统症状者。Rh溶血需选用Rh阴性血,ABO溶血则用O型红细胞与AB型血浆的混合血。
真实案例参考:一位ABO溶血患儿经蓝光治疗3天后胆红素从18mg/dL降至9mg/dL,配合铁剂补充纠正贫血,2周后康复。
1. 孕前干预
2. 孕期防护
3. 产后预警
✓ 黄疸24小时内出现或波及手足心
✓ 拒奶、嗜睡、哭声尖锐
✓ 大便灰白或尿液呈浓茶色。
新生儿溶血性贫血虽具危险性,但通过规范产检、早期识别和精准治疗,绝大多数患儿可获得良好预后。建议准父母主动参与血型筛查,高危群体配合医生制定个体化防控方案,将疾病风险降至最低。