前列腺癌是男性最常见的恶性肿瘤之一,尤其在老年群体中发病率逐年上升。随着医学研究的深入,靶向治疗因其精准性和低毒副作用,逐渐成为对抗前列腺癌的重要武器。本文将从治疗机制、最新药物进展到患者实用建议,全面解析这一领域的科学突破。

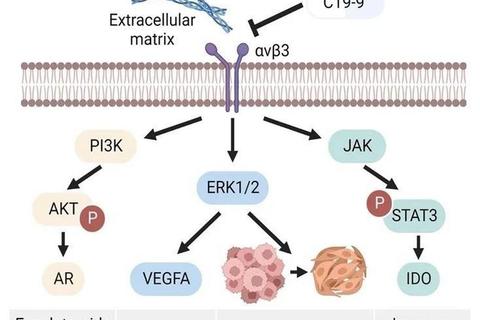
前列腺癌的进展与雄激素受体(AR)信号通路密切相关。正常状态下,雄激素(如睾酮)与AR结合后调控细胞生长,但癌细胞会通过基因突变、信号通路异常激活等方式逃逸调控,导致疾病恶化。传统的内分泌治疗(如雄激素剥夺疗法)虽能暂时控制病情,但多数患者最终会发展为去势抵抗性前列腺癌(CRPC),此时癌细胞对激素治疗不再敏感,生存率显著下降。
典型症状与诊断
早期前列腺癌常无症状,随着肿瘤增大可能出现排尿困难、血尿、骨盆疼痛等。诊断依赖PSA(前列腺特异性抗原)检测、影像学检查及组织活检。晚期患者可能出现骨转移,表现为骨痛或病理性骨折。
靶向药物通过精准干预癌细胞的特定分子机制发挥作用,目前主要分为以下三类:
1. 雄激素受体拮抗剂
这类药物直接阻断雄激素与受体的结合,抑制AR信号通路。
2. PARP抑制剂
针对DNA修复缺陷的癌细胞,通过“合成致死”效应杀死肿瘤。
3. 免疫治疗与新型靶点药物
1. 新辅助治疗的优化
术前使用靶向药物缩小肿瘤,可提高手术成功率。例如,氟唑帕利联合阿比特龙治疗高危患者,术后2年无转移生存率达94%。未来研究将结合基因检测筛选获益人群,避免过度治疗。
2. 个体化精准治疗
基因检测(如HRR突变、PTEN缺失)是选择治疗方案的关键。例如,双等位BRCA2突变患者对PARP抑制剂更敏感,而PTEN缺失患者可能受益于AKT抑制剂Truqap。
3. 耐药性应对策略
4. 预后标志物与动态监测
中国学者发现的16蛋白标志物组合可预测生化复发风险,准确率优于传统临床指标,指导术后干预。液体活检(如循环肿瘤DNA)也在探索中,有望实现无创监测。
1. 早期筛查与定期随访
2. 治疗选择与副作用管理
3. 生活方式与心理支持
2025年多项III期临床试验结果值得期待,如诺华的Pluvicto在高肿瘤负荷患者中的生存数据、阿斯利康Truqap在PTEN缺失人群的疗效。人工智能将加速药物研发,通过多组学数据预测最佳治疗方案。
总结
前列腺癌的靶向治疗已从“一刀切”迈入精准医学时代。患者应积极与医生沟通,结合基因检测制定个性化方案。科学进步与患者教育的结合,将为战胜这一疾病带来更多希望。