新生儿视网膜渗出是临床常见的眼底病变,尤其高发于早产儿群体。随着新生儿重症监护技术的进步,早产儿存活率显著提升,但视网膜渗出等并发症的防治仍面临挑战。本文将从病理机制、临床表现及干预策略等角度,系统解析这一疾病的最新研究进展。

视网膜渗出的本质是视网膜血管屏障破坏导致液体和脂质外渗。在早产儿中,视网膜血管发育不成熟是核心诱因:正常视网膜血管在孕16周开始形成,至孕36周才完成。早产儿需接受氧气支持,但高浓度氧会抑制血管内皮生长因子(VEGF),导致血管发育停滞;当氧浓度降低时,VEGF等促血管生成因子又异常激增,引发血管渗漏。
关键分子机制包括:
1. VEGF信号通路失衡:早产儿视网膜中VEGF水平波动显著,刺激新生血管形成的同时破坏血-视网膜屏障。
2. 炎症反应:缺氧诱导的炎症因子(如TNF-α、IL-6)激活免疫细胞,加剧血管渗漏。
3. 氧化应激:氧自由基损伤视网膜色素上皮细胞,导致液体代谢障碍。
妊娠期高血压、糖尿病等母体疾病也会通过胎盘功能异常影响胎儿视网膜微环境。
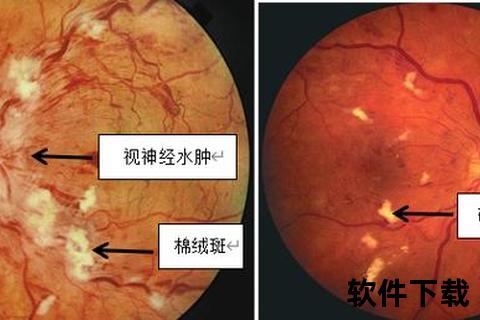
视网膜渗出早期可能无显著症状,需通过专业筛查发现。根据渗出形态可分为两类:
1. 软性渗出(棉絮状斑):边界模糊的灰白色斑块,提示毛细血管前小动脉阻塞导致的神经纤维层微小梗死。
2. 硬性渗出:蜡黄色点片状沉积,多分布于黄斑区,常伴随脂质代谢异常。
高危预警信号包括:
值得注意的是,急进型ROP可在数日内发展为视网膜脱离,需紧急干预。
1. 眼底筛查金标准:采用间接检眼镜或RetCam广域成像系统,评估视网膜分区(Ⅰ-Ⅲ区)、病变分期(1-5期)及附加病变。
2. 光学相干断层扫描(OCT):可定量测量视网膜厚度,识别黄斑水肿。
3. AI辅助诊断系统:深度学习算法通过分析后极部血管形态,可自动识别附加病变并预测疾病进展,准确率达94%。
筛查时机建议:首次检查应在矫正胎龄32周或出生后4-6周,高风险患儿需每1-2周复查。
4期以上病变需行玻璃体切除术,5期闭漏斗型脱离需联合晶状体切除及视网膜复位术。
1. 产前干预:控制妊娠期高血压、糖尿病,降低早产风险。
2. 氧疗管理:新生儿ICU需动态监测血氧饱和度,维持90-95%的理想范围。
3. 家庭护理:
新生儿视网膜渗出的防治需要产科、新生儿科与眼科的全程协作。建议医疗机构建立“筛查-诊断-随访”一体化流程,家长则需强化疾病认知,把握0-3岁的视觉发育关键期。随着AGGF1基因疗法和AI筛查系统等新技术的发展,未来有望实现更早预警和个性化治疗。
就医提示:若发现婴儿出现眼球震颤、对强光无反应或瞳孔反白,请立即至具备ROP诊疗资质的眼科中心就诊,延误治疗可能导致不可逆视力损伤。