痛风,这一古老的“帝王病”,如今已成为困扰现代人的常见代谢性疾病。其急性发作时的剧烈疼痛常被为“刀割样”“撕裂样”,甚至可能因轻微触碰床单而痛不欲生。随着医学研究的深入,新一代痛风消炎止痛药物在镇痛速度、安全性及长期管理方面展现出突破性进展。本文将从科学机制、用药选择及特殊人群管理三大维度,解析如何在这场“晶体战争”中快速控制疼痛,同时避免治疗陷阱。
一、痛风疼痛的“炎症风暴”:机制与新药靶点
痛风急性发作的本质是尿酸盐晶体触发中性粒细胞主导的炎症级联反应。最新研究发现,尿酸盐晶体通过激活NLRP3炎症小体,引发IL-1β等促炎因子爆发性释放,导致血管扩张、组织水肿和神经末梢敏化。
新一代药物的快速镇痛机制:
1. IL-1β单克隆抗体(如卡那单抗):直接阻断炎症核心通路,临床试验显示,单次皮射150mg可在72小时内显著缓解疼痛,尤其适用于传统药物无效的重症患者。
2. 新型尿酸氧化酶偶联物(UOx-PLP):通过聚脯氨酸修饰技术延长半衰期至72小时,同时降低免疫原性,动物模型中血尿酸水平在给药后4小时下降50%,且无抗体加速清除现象。
3. 肾脏转运蛋白抑制剂(如SAP-001):选择性抑制URAT1之外的尿酸排泄通道,2b期研究显示60mg剂量组6个月持续达标率超90%,且无显著肾毒性。
二、急性期用药策略:从“三板斧”到精准分层
(一)传统药物优化方案
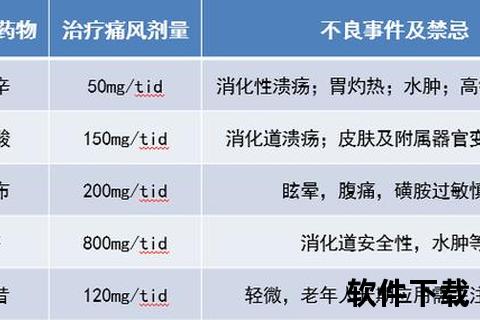
1. 秋水仙碱:低剂量革命
科学剂量:2020年美国风湿学会明确反对说明书大剂量方案,推荐首剂1.2mg,1小时后追加0.6mg,24小时总量不超过1.8mg。这种“脉冲式”给药可使胃肠道副作用发生率从80%降至20%。
特殊警示:肾功能不全者(eGFR<30ml/min)需减量50%,同时避免与克拉霉素、环孢素等P-gp抑制剂联用。
2. 非甾体抗炎药(NSAIDs)的精准选择
心血管风险分级:
低风险:首选萘普生(500mg bid),其血栓风险低于其他COX-2抑制剂。
高风险:依托考昔60mg qd,5天内使用不增加心梗风险,但需监测血压。
胃黏膜保护策略:高危人群(年龄>65岁或既往溃疡史)需联用质子泵抑制剂,如奥美拉唑20mg qd。
3. 糖皮质激素的“时空控制”
关节腔注射:单关节发作时,40mg曲安奈德局部注射可较口服泼尼松提前12小时起效。
口服阶梯减量:泼尼松30mg/d起始,每3天减量5mg,总疗程不超过14天,突然停药易致反跳。
(二)特殊场景的联合用药
顽固性疼痛:秋水仙碱0.5mg bid + 塞来昔布200mg qd,较单药有效率提升35%。
肾功能不全:关节腔注射激素+小剂量泼尼松(10mg/d),避免NSAIDs和秋水仙碱的肾毒性叠加。
三、安全用药的“红绿灯法则”
(一)绝对禁忌信号(uD83DuDEA8)
NSAIDs:活动性消化道出血、冠状动脉搭桥术后3个月内禁用。
秋水仙碱:与克拉霉素联用可致致死性肌溶解。
激素:未控制的糖尿病、青光眼患者禁用关节腔注射。
(二)特殊人群管理
1. 孕妇:
孕早期:仅限关节腔注射激素(如地塞米松磷酸钠)。
孕中晚期:低剂量泼尼松(≤10mg/d)短期使用,避免NSAIDs致胎儿动脉导管早闭。
2. 儿童痛风:
12岁以上可谨慎使用萘普生(10mg/kg/d),禁用依托考昔。
遗传性痛风(如Lesch-Nyhan综合征)需早期启动拉布立酶治疗。
3. 慢性肾病:
eGFR 30-60ml/min:秋水仙碱剂量≤0.6mg/d,联合碳酸氢钠碱化尿液。
eGFR<30ml/min:禁用别嘌醇,非布司他起始剂量20mg/d,需监测血钾。
四、预防复发的“三级防御体系”
1. 急性期管理(0-2周):
冰敷患肢(每次15分钟,间隔1小时),抬高肢体30°以上减轻水肿。
严格限制果糖摄入(每日<25g),避免含糖饮料诱发尿酸升高。
2. 降尿酸启动时机:
传统观点主张症状缓解2周后起始,但2023年EULAR指南更新:在充分抗炎(秋水仙碱0.5mg qd)保护下,急性期即可开始小剂量非布司他(10mg/d)。
3. 长期监测网络:
每3月检测血尿酸(目标<360μmol/L),痛风石患者需<300μmol/L。
便携式尿酸仪(如爱科来UC-3500)家庭监测,波动超过20%及时复诊。
五、未来展望:个体化治疗的曙光
2025年进入Ⅲ期临床的SAP-001,通过靶向肾脏新型转运蛋白,实现“精准排酸”,临床试验显示其对别嘌醇耐药患者的血尿酸达标率达97%。而基于CRISPR技术的基因编辑疗法,已在动物模型中成功修复URAT1基因突变,为遗传性痛风带来根治希望。
在这场与尿酸盐的持久战中,患者需牢记:疼痛缓解只是战役的开始,持续的血尿酸管理才是赢得战争的关键。当突发剧痛时,请遵循“冰敷-药物-就诊”的三步应急法则,让科学的力量助您早日走出疼痛阴霾。
